Aký je celkový stav hmoty
Sú známe tri hlavné agregátne stavylátky: plyn, kvapalina a tuhá látka. Veľmi viskózne kvapaliny môžu vyzerať ako pevné telá, ale od nich sa líšia v charaktere tavenia. Moderná veda tiež rozlišuje štvrtý celkový stav hmoty - plazma, ktorá má mnoho nezvyčajných vlastností.
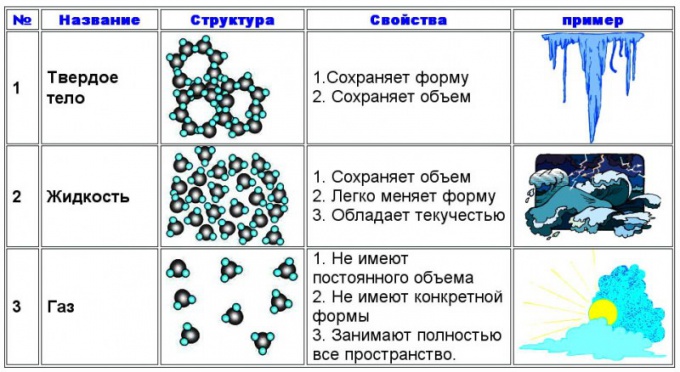
Vo fyzike je akceptovaný celkový stav hmotynazývajú ju schopnosťou udržiavať svoj tvar a objem. Ďalším znakom sú spôsoby prenosu podstaty jedného agregátu do druhého. Vychádzajúc z toho sú rozlíšené tri agregátne stavy: pevná, kvapalná a plyn. Viditeľné vlastnosti sú: - pevné telo - zachováva tvar i objem. Môže prechádzať do kvapaliny tavením a priamo do plynu sublimáciou - kvapalina - zachováva objem, ale nie tvorí, to znamená, že má tekutosť. Rozliata kvapalina má tendenciu neobmedzene sa šíriť po povrchu, na ktorý sa naleje. V pevnej látke môže kvapalina prejsť kryštalizáciou a do plynu - odparovaním. - Plyn - nezachováva žiadnu formu ani objem. Plyn mimo akúkoľvek nádobu má tendenciu expandovať neobmedzene vo všetkých smeroch. To môže byť obmedzené len gravitáciou, takže zemská atmosféra sa nerozptýli do vesmíru. V kvapaline prechádza plyn kondenzáciou a priamo do pevnej látky môže prechádzať zrážaním.
Fázové prechody
Prechod hmoty z jedného agregátneho stavudo druhého sa nazýva fázový prechod, ako vedecký synonymum skupenstvo - fáza hmoty. Napríklad voda môže existovať v pevnej fáze (ľad), kvapalina (čistá voda) alebo plynnej (parné) vody .Na príklad tiež ukazuje dobrú sublimáciu. Visel sušiť v lodenici v mrazivých pokojný deň bielizeň okamžite zmrazí, ale o niečo neskôr ukáže, že suchá: ľad sublimuje priamo do vody prechádzajúcej par.Kak Typicky fázový prechod z pevného do kvapaliny a plynu vyžaduje zahrievanie, avšak pri rovnakej teplote okolia to nestúpa: tepelná energia ide do porušenia interných spojov v materiáli. Táto tzv latentné teplo fázového prechodu. Pri inverzný fázový prechod (kondenzácia, kryštalizácia) toto teplo vydelyaetsya.Imenno tak nebezpečné parný popáleniny. Na pokožke sa kondenzuje. Latentné teplo odparovania / kondenzácie vody je veľmi vysoká: voda v tomto ohľade - anomálne látka; preto je život na zemi možný. Keď obarenia skupenské teplo kondenzácie vody "proshparivaet" spálené miesto veľmi hlboký a účinky parnej popálenín je oveľa ťažšie, než plameňa na rovnaké časti tela.pseudophases
Fluidita kvapalnej fázy látky je určená jejviskozitu a viskozitu - povahu vnútorných väzieb, ktorému je venovaná ďalšia časť. Viskozita kvapaliny môže byť veľmi vysoká, a ako kvapalina môže prúdiť bezproblémovo glaza.Klassichesky napríklad - sklo. Nie je to pevné telo, ale veľmi viskózna kvapalina. Vezmite prosím na vedomie, že sklenené tabule v sklade nie sú nikdy uložené opreté o stenu. O niekoľko dní neskôr sa ohýbajú pod svojou vlastnou váhou a bude nevhodné pre príklady upotrebleniyu.Drugie pseudo-orgánov - Var topánky a stavebných živice. Ak zabudnete uhlový kus asfaltového strechou, cez leto sa bude šíriť do torty a lepiť sa k báze. Pseudo teleso možno odlíšiť od skutočného charakteru topenia: reálne alebo ak sa udržať svoj tvar do naraz nie je rastekutsya (spájka pre spájkovanie) alebo žľabu, a bazény fúkanie prúdov (ICE). Vysoko viskózna kvapalina je postupne zmäkol, ako rovnakú rozostupom alebo bitum.Chrezvychayno viskózne kvapaliny, tekutosti, nie sú zrejmé na mnoho rokov a desaťročí, sú plastové. Vysoká schopnosť udržiavať tvar je veľké molekulovej hmotnosti polymérov v mnohých tisícov a miliónov atómov vodíka. Štruktúra fáz hmoty
V plynnej fáze, molekuly alebo atómy hmotysú od seba oddelené veľmi ďaleko, mnohokrát väčšie ako vzdialenosť medzi nimi. Spolupracujú navzájom príležitostne a nepravidelne, len pri kolíziách. Veľmi elastické interakcie: došlo ako tvrdé guličky, a ihneď molekúl razletelis.V / atómy kvapaliny neustále "pocit" navzájom na úkor veľmi slabých väzieb chemická povaha. Tieto väzby sú vždy znova roztrhané a okamžite obnovené, molekuly tekutiny sa kontinuálne pohybujú navzájom, takže tekutina prúdi. Aby však bolo možné premeniť ju na plyn, je potrebné okamžite prerušiť všetky väzby, ale to vyžaduje veľa energie, pretože kvapaliny a udržiava obem.Voda v tomto ohľade líši od ostatných látok, v tom, že jeho molekuly v kvapaline sú spojené tzv vodíkových väzieb je pomerne silný , Preto môže byť voda pri normálnej teplote tekutá. Mnoho látok s molekulovou hmotnosťou v poriadku desiatok či stoviek krát väčšia ako voda za normálnych podmienok - plyny sú aspoň normálne domáce gaz.V pevné všetky jej molekuly sú pevne na svojom mieste vďaka silnej chemické väzby medzi nimi, tvorí kryštálovej mriežke , Kryštály pravidelného tvaru vyžadujú špeciálne podmienky pre ich rast, a preto sa zriedka vyskytujú v prírode. Väčšina pevné látky sú pevne spojené síl na mechanické a elektrické povahu konglomerátov malých a malé kryštály - čitatelia kristallitov.Esli videli, napríklad prasknutá podlaha vozidla alebo liatinový rošt, kryštalické zrná na prelome je možno vidieť voľným okom. A na fragmenty rozbitého porcelánového alebo fajánskeho tovaru je možné ich pozorovať pod lupou.plazma
Fyzici identifikujú štvrtý agregátny stavlátka - plazma. V plazme, elektróny sú oddelené od atómových jadier, a to je zmes elektricky nabitých častíc. Plazma môže byť veľmi hustá. Napríklad jeden kubický centimeter plazmy z vnútra hviezd - bielych trpaslíkov, váži desiatky a stovky tonn.Plazmu vyhradiť samostatný fyzický stav, pretože je aktívne spolupracuje s elektromagnetickými poľami vzhľadom na to, že jeho častice sú nabité. Vo voľnom kozmickom plazmy má tendenciu expandovať, ochladenie a sústruženie na plyn. Ale pod vplyvom elektromagnetického poľa mimo nádoby, môže udržať svoj tvar a objem, vo forme pevnej látky. Táto vlastnosť sa používa v energetických reaktoroch termojadrovej plazmy - prototyp budúcich elektrární.








